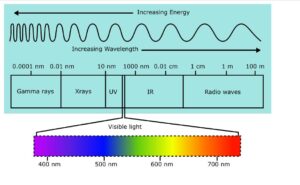
طیف سنجی شاخه ای از شیمی است که به اندازه گیری های تحقیقی طیف مربوط می شود. طیف سنجی یا طیف سنجی UV-VIS (فرابنفش- مرئی) مطالعه برهمکنش نور با ماده در سطوح الکترونیکی است. از ناحیه فرابنفش سطح خلاء یعنی 180 نانومتر تا ناحیه مرئی یعنی 780 نانومتر متغیر است. طیف UV از 180 نانومتر تا 400 نانومتر گسترش مییابد در حالی که محدوده مرئی از 400 نانومتر تا 780 نانومتر است.
طیف سنجی UV-VIS یک تکنیک ابزاری است که برای تجزیه و تحلیل شیمیایی استفاده می شود. برای تجزیه و تحلیل کیفی و همچنین کمی استفاده می شود. این تکنیک برای تعداد زیادی از ترکیبات کاربردهای متعددی دارد. برای مشاهده رفتار نوری ترکیبات شیمیایی، شناسایی گونه های مختلف و تعیین کمیت آنالیت های خاص استفاده می شود.
طیف سنجی UV-Visible
در طیفسنجی UV-VIS، انتقال الکترونها در سطوح مختلف با جذب تشعشع از ناحیه فرابنفش به ناحیه مرئی در یک نمودار رسم میشود. این نمودار خطی از جذب های مختلف در سطوح خاصی از تشعشعات به دلیل ظرفیت جذب ترکیبات در سطوح مشخص است. این سطوح را مناطق جذب و ترکیبات را کروموفور می نامند.
کروموفورها تقریباً در هر ترکیبی وجود دارند. این را می توان با این واقعیت استنباط کرد که تقریباً تمام ترکیبات و به خصوص ترکیبات آلی را می توان با طیف سنجی uv-vis شناسایی و کمیت کرد.
اصل کار طیف سنجی مرئی UV
هنگامی که یک ترکیب شیمیایی نور را جذب می کند، برخی از فرآیندهای تحریک و غیرتحریک الکترون ها در اتم ها رخ می دهد که منجر به تولید طیف متمایز می شود.
طیف الکترومغناطیسی
طیف الکترومغناطیسی تقسیم تابش الکترومغناطیسی بر اساس انرژی، فرکانس یا طول موج فوتون است.
اسپکترو فوتو متر چیست؟
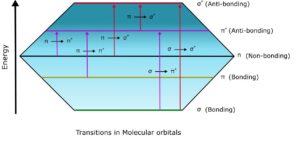
برهمکنش تشعشع و ماده در تجزیه و تحلیل طیف سنجی، هنگامی که تابش ها با یک گونه شیمیایی برهمکنش می کنند، می توانند باعث انتقال در سطوح مختلف انرژی شوند. نوع انتقال به انرژی تابش و حالت تشخیص بستگی دارد. انتقال الکترون ها همیشه از حالت پایه HOMO کم انرژی (بالاترین اوربیتال مولکولی اشغال شده) به حالت تحریک شده با انرژی بالاتر LUMO (پایین ترین اوربیتال مولکولی اشغال نشده) اتفاق می افتد.
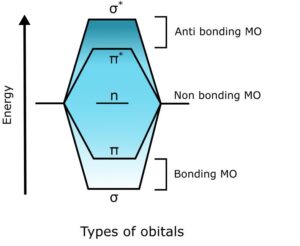
همپوشانی اوربیتال های اتمی سه نوع اوربیتال مولکولی را تشکیل می دهد. کل این مفهوم از نظریه اوربیتال مولکولی (MOT) ناشی می شود. پیوند اوربیتال های مولکولی با انرژی کمتر. اوربیتال های مولکولی غیرپیوندی با انرژی میانی. اوربیتال های مولکولی ضد پیوند دارای انرژی بالاتری هستند.
نظم انرژی در انتقال های الکترونیکی
انتقالهای الکترونیکی که به بالاترین انرژی نیاز دارند، انتقالهای الکترونیکی σ-σ* هستند، در حالی که انتقالهایی که به کمترین انرژی نیاز دارند، انتقالهای الکترونیکی n-π* هستند.
ترتیب انرژی انواع مختلف انتقال الکترونیکی به شرح زیر است.
σ-σ* > n-σ* > π-π* > n-π*
این پدیده تحت قانون بیر-لامبرت مورد مطالعه قرار گرفته است.
قانون لامبرت
قانون لامبرت نشان میدهد که جذب «A» نور تک رنگ فرودی مستقیماً با طول مسیر (طول سلول) «ℓ» متناسب است. این بدان معنی است که بخش های مساوی از مواد جاذب، بخش های مساوی از نور فرودی را جذب می کنند.
A ∝ ℓ
قانون آبجو
قانون آبجو به این معنی است که جذب “A” نور فرودی یا تابش الکترومغناطیسی مستقیماً با غلظت “c” محلول متناسب است. این قانون رابطه کمی بین شدت تابش و غلظت گونه های شیمیایی را نشان می دهد.
A ∝ c
قانون بیر-لامبرت
در مجموع قوانین بیر و لامبرت بیان می کنند که جذب “A” یک پرتو تک رنگ فرودی مستقیماً با غلظت “c” محلول و طول مسیر “ℓ” متناسب است.
میزان کاهش شدت نور تک رنگ متناسب با ضخامت محیط «ℓ» و غلظت «c» ماده جاذب در رقت است.
A∝ c. ℓ
A = ε. ج . ℓ
جایی که،
ε ثابت ضریب جذب مولی است.
یا
ε میزان جذب محلولی با غلظت 1 mol/dm-3 و طول مسیر 1 سانتی متر است.
جذب
این نسبت شدت تابش الکترومغناطیسی فرود از منبع به تابش الکترومغناطیسی شکستی است که توسط آشکارساز تشخیص داده می شود.
نمایش ریاضی:
A = ورود به سیستم ℓo / ℓ
A = ε. ج . ℓ
بنابراین،
ورود به سیستم ℓo / ℓ = ε . ج . ℓ
عبور
نسبت توان تشعشعات الکترومغناطیسی است که از Pt نمونه خارج می شود به تابش تابشی روی نمونه از منبع.
نمایش ریاضی از نظر انتقال
T= Pt / Po
% T = T × 100
% T = Pt / Po × 100
تبدیل جذب به انتقال
A = – ورود T
A = – log Pt / Po (از آنجایی که T = Pt / Po)
A = log Po / Pt
A = 2- ورود T %
% T = آنتیلوگ (2 – A)
محدودیت های قانون آبجو لامبرت
منبع نور مورد استفاده باید تک رنگ باشد.
این برای محلول های غلیظ مناسب نیست، یعنی فقط برای محلول های رقیق قابل استفاده است.
با افزایش رقت، تجزیه اسیدهای ضعیف رخ می دهد. اسیدهای ضعیف با باز مزدوج خود به تعادل می رسند. اسید (HA) و باز مزدوج (A-) نمی توانند جذب یکسانی داشته باشند. از این رو این قانون به طور کامل برای محلول های اسیدی ضعیف قابل اجرا نیست.
مطالب مرتبط
طیف سنجی جذب اتمی
طیف سنجی انتشار اتمی
ابزار دقیق طیف سنجی مرئی UV
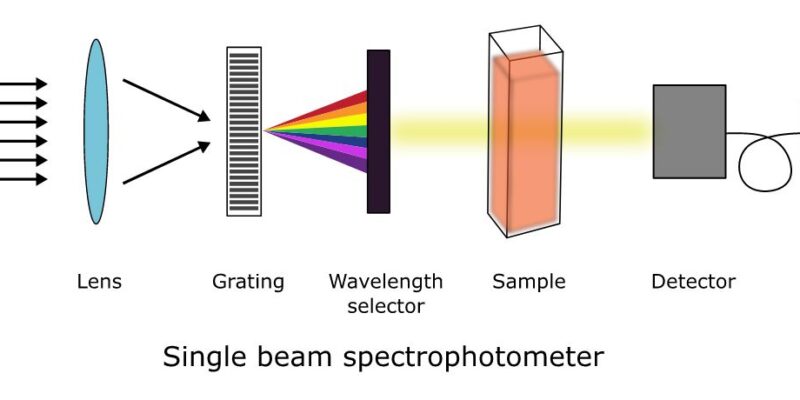
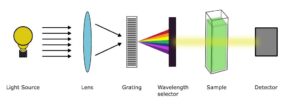
ابزار دقیق طیف سنج UV-vis شامل موارد زیر است
منبع نور
توری پراش
انتخابگر طول موج
ظرف یا کووت نمونه
آشکارساز
اندازه کووت
رایج ترین اندازه کووت 1 سانتی متر است، اگرچه می تواند از 0.1 تا 10 سانتی متر متغیر باشد.
4. آشکارسازها
آشکارسازها وسایلی هستند که وجود یک پدیده فیزیکی را نشان می دهند. چند نمونه از آشکارسازهای ساده هستند
مبدل ها
ردیاب های نوری
فیلم های عکاسی
سطح جیوه در دماسنج ها (ردیاب دما)
چشم انسان
مبدل ها
مبدل نوع خاصی از آشکارساز است که سیگنال هایی مانند شدت نور، pH، جرم و دما و غیره را به سیگنال های الکتریکی تبدیل می کند. این سیگنال الکتریکی تقویت و دستکاری می شود. سیگنال به صورت اعداد نمایش داده می شود (شکل دیجیتال).
خواص مبدل ها
مبدل ها پاسخ سریعی به سطوح پایین انرژی تابشی ایجاد می کنند.
مناسب برای طیف وسیعی از طول موج ها.
سیگنال های الکتریکی تولید شده توسط مبدل ها باید نویز کمی داشته باشند.
سیگنال تولید شده توسط مبدل نسبت مستقیمی با پرتو قدرت دارد.
ردیاب های نوری
آشکارسازهای نوری به صورت زیر استفاده می شوند:
لوله های عکس
لوله های فتومولتیپلایر
دیودهای سیلیکونی
سلول های فتوولتائیک
لوله های عکس
لوله های عکس یا سلول های تابشی نور نوعی آشکارساز نوری هستند. آنها سطوح مقعر کاتد و آند در داخل یک حباب شیشه ای هستند. کاتد با مواد تابش نور پوشیده شده است. به عنوان مثال، سریم، اکسید پتاسیم، اکسید نقره و غیره. آند یک ورق یا حلقه فلزی در ولتاژ بالا توسط باتری است. داخل لامپ با فشار کم با گاز بی اثر پر می شود.
لوله های فتومولتیپلایر
لوله های فتومولتیپلایر به صورت داینودهای مکرر در زوایای خاص ساختار یافته اند. الکترون های ساطع شده به داینودهای مختلف برخورد می کنند. هر داینود دارای ولتاژ بالایی نسبت به داینودهای قبلی است. این اختلاف ولتاژ باعث تسریع الکترون ها می شود. این الکترون های سریع با برخورد به داینودهای بعدی، الکترون های بیشتری را از بین می برند.
تکرار فرآیند فوق باعث می شود تا 106 الکترون برای هر فوتون جمع آوری شود و به کاتد اول برخورد کند.
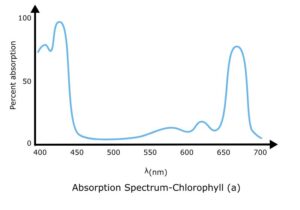
آنالیز طیفی طیفسنجی uv-vis نیز برای آنالیز کمی آنالیتها استفاده میشود. جذب در طول موج مشخصی از نور به طور مستقیم با غلظت طبق قانون بیر-لامبرت متناسب است.
تغییر باند جذب و تغییر در شدت
کروموفورها
کروموفور یک اتم یا گروهی از اتمها است که مسئول جذب پرتوهای مرئی UV هستند.
انواع کروموفورها
دو نوع کروموفور وجود دارد:
کروموفورهایی که فقط می توانند حاوی الکترون π باشند. آنها فقط تحت انتقال π-π* هستند، به عنوان مثال. گروه اتیلن (C=C) و گروه استیلن (C≡C) و غیره.
کروموفورهایی که حاوی π و همچنین n الکترون (غیر پیوندی) هستند. این نوع کروموفور حاوی جفت(های) تک الکترون است. بنابراین آنها مسئول دو نوع انتقال هستند، یعنی n-π* و π-π* به عنوان مثال. گروه نیترو (-NO2)، گروه آزو (-N=N-)، گروه نیترو (-NO3)، گروه کربونیل (>C=O)، گروه نیتریت (-ONO).
Auxochromes
اکسوکروم اتم یا گروهی از اتمها است که به خودی خود نوار جذبی ایجاد نمیکنند، اما ویژگیهای جذب کروموفور را تغییر میدهند. اکسوکروم ها ممکن است شدت و طول موج کروموفور را با اضافه شدن به آن تغییر دهند.
به آن گروه تقویت کننده رنگ نیز می گویند. جایگزینی هیدروژن روی یک کروموفور اساسی ویژگی های جذب آن را تغییر می دهد. به عنوان مثال متیل (-CH3،)، کلرید (Cl-)، هیدروکسیل (OH-)، آمینو (-NH2)، آلکوکسی (CH3O-)، و غیره.
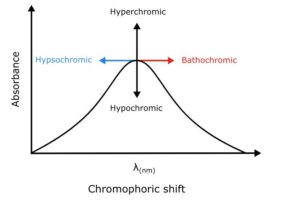
چهار نوع تغییر مربوط به اکسوکروم وجود دارد:
تغییر باتوکرومیک (تغییر قرمز)
تغییر هیپسوکرومیک (تغییر آبی)
تغییر هایپرکرومیک
تغییر هیپوکرومیک
جابجایی باتوکرومیک یا انتقال قرمز
تغییر باتوکرومیک تغییر موقعیت باند جذب به سمت طول موج بلندتر است. این تغییر در حضور اکسوکروم یا تغییر در حلال رخ می دهد.
شیفت هیپسوکرومیک یا شیفت آبی
تغییر هیپسوکرومیک تغییر در موقعیت باند طیفی به سمت طول موج کوتاهتر است. این به دلیل حذف کونژوگه یا تغییر در قطبیت حلال رخ می دهد.
تغییر هایپرکرومیک
شیفت هایپرکرومیک افزایش شدت باند جذب یعنی εmax است. یک جابجایی هایپرکرومیک به دلیل وجود یک اکسوکروم رخ می دهد.
تغییر هیپوکرومیک
تغییر هیپوکرومیک کاهش در شدت جذب یعنی باند εmax است.
اثر ویژگی های افزودنی
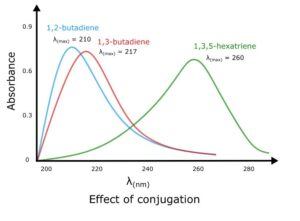
هنگامی که یک مولکول حاوی دو یا چند کروموفور است که با بیش از یک پیوند مجزا از هم جدا شده اند، جذب کل برابر است با مجموع ویژگی های جذب هر کروموفور.
به عنوان مثال، اتیلن و 1.5 هگزادین طول موج یکسانی را جذب می کنند. اما مقدار تابش جذب شده برای غلظت های مشابه برای 1.5 هگزادین تقریبا دو برابر اتیلن است.
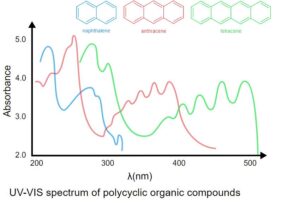
اثر حلقه معطر
حلقه معطر به ویژه هنگامی که دو یا چند حلقه به صورت مزدوج (ترکیبات چند حلقه ای) طول موج بالاتری را در ناحیه مرئی جذب می کنند، طیف جذب را تغییر می دهد.
مثلا
نفتالین (C6H6) در 268 نانومتر جذب می شود
آنتراسن در طول موج 311 نانومتر جذب می شود
تتراسن در طول موج 476 نانومتر جذب می شود
اثر جایگزینی اکسوکروم
بنزن یک کروموفور کمتر موثر است، جایگزینی یک گروه قطبی به آن باعث افزایش λmax در ناحیه مرئی و در نتیجه افزایش مقدار εmax می شود.
| Auxochrome | Compound | λ(max) | ε(max) |
| — | Benzene | 256 | 250 |
| -NH2 | Aniline | 280 | 200 |
| -Cl | Chlorobenzene | 265 | 360 |
| n-π* Transitions | Solvent | Absorption wavelength |
| Hexane | 279nm | |
| Methanol | 270 nm | |
| Water | 264 nm |
در حالی که برای انتقال π-π* اوربیتال π* قطبی تر از اوربیتال π است بنابراین در حضور یک حلال قطبی به میزان بیشتری تثبیت می شود. این باعث یک جابجایی باتوکرومیک می شود زیرا شکاف انرژی بین π-π* به دلیل پایداری اوربیتال π* کاهش می یابد.
| π-π* Transitions | Solvent | Absorption wavelength |
| Hexane | 230 nm | |
| Water | 243 nm |
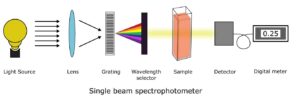
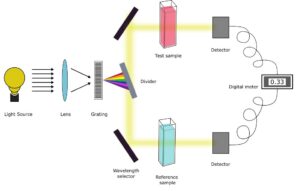
کاربردهای طیف سنجی UV-Vis
طیفسنجی مرئی UV برای شناسایی گونههای آلی و معدنی موجود در محلول استفاده میشود.
برای یافتن غلظت محلول مجهول استفاده می شود.
برای تعیین ساختار در کنار سایر داده ها مانند باندها و شدت گروه های عاملی از طیف سنجی مرئی UV استفاده می شود.
همچنین در مطالعه سینتیک شیمیایی یعنی ناپدید شدن یک گروه عاملی و ظاهر شدن یک گروه عملکردی دیگر استفاده می شود.
طیفسنجی مرئی UV برای مطالعه ایزومرها استفاده میشود، بهعنوان مثال، در ایزومریسم هندسی، گونههای ترانس، طول موج بالایی با مقدار جذب مولی بزرگ «ε» نسبت به گونههای سیس جذب میکنند.
در تشخیص یا حضور صرف کمک می کند.
طیف سنجی UV-vis در کلینیک ها و بیمارستان ها برای تجزیه و تحلیل دارو استفاده می شود.
در صنایع پتروشیمی کاربرد دارد.
طیفسنجی مرئی UV در آزمایشگاههای کنترل کیفیت آب استفاده میشود.
در آزمایشگاه های پزشکی قانونی استفاده می شود.
یکی دیگر از کاربردهای مهم طیف سنجی مرئی UV در زمینه گیاهان شیمیایی و بیولوژیکی است.
برای تحلیل کیفی از حداکثر جذب و برای تحلیل کمی از قانون آبجو لامبرت استفاده می شود.
مفاهیم برگ
اسپکتروفتومتر UV-Vis چیست؟
اسپکتروفتومتر Uv-vis ابزاری است که در آن تابش نواحی فرابنفش و مرئی با محلول نمونه برهمکنش میکند. الکترون ها هنگام جذب بخشی از تابش فرودی و انتقال دیگری برانگیخته می شوند. این تشعشعات ارسالی شناسایی، تقویت، ثبت و بر روی دستگاه بازخوانی به صورت درصد عبور نمایش داده می شود.
چه اطلاعاتی را می توان از طیف UV-Vis بدست آورد؟
طیف مرئی UV ناحیه جذب تشعشع یک ترکیب را توضیح می دهد. هنگامی که نور مرئی UV با ماده برخورد می کند، مقداری از نور در مولکول های ترکیب جذب می شود و بقیه از طریق آن منتقل می شود. این نور عبوری نشان می دهد که چه مقدار نور توسط نمونه جذب می شود (غایب از تابش شکست).
اصل طیف سنجی مرئی UV چیست؟
اصل اساسی طیفسنجی مرئی UV بر اساس جذب نور (محدوده از -nm) توسط ترکیبات شیمیایی مختلف است. این برهمکنش نور ماوراء بنفش و مرئی با ماده است. هر ترکیب شیمیایی دارای یک طیف خاص یا متمایز است زیرا فقط طول موج خاصی از نور (تابش) را جذب می کند.
قانون لامبرت آبجو چگونه در طیف سنجی استفاده می شود؟
قانون آبجو لامبرت برای تعیین گذر “T” و جذب “A” یک محلول در یک سلول شفاف با طول مسیر “ℓ” استفاده می شود. بر اساس این قانون، غلظت آنالیت جذب کننده با جذب و طول مسیر سلول نسبت مستقیم دارد.
A = – log T = log Po / P = ε . ج . ℓ
طیف سنجی مرئی UV برای چه مواردی استفاده می شود؟
طیفسنجی مرئی UV برای شناسایی گروههای عاملی، آنالیز آب و اندازهگیری غلظت آنالیت با استفاده از قانون لامبرت بیر استفاده میشود. همچنین برای اندازه گیری کمی DNA، RNA و پروتئین ها در محلول نمونه استفاده می شود. UV قابل مشاهده به طور گسترده ای در آزمایشگاه های پزشکی قانونی، مواد شیمیایی، محیط زیست و بالینی استفاده می شود. طیف سنج مرئی UV به عنوان آشکارساز برای تکنیک های تحلیلی مختلف مانند کروماتوگرافی استفاده می شود.
اسپکترو فوتو متر چیست؟
کاربردهای طیف سنجی مرئی UV چیست؟
طیفسنجی مرئی UV در زمینههای مختلف از جمله آنالیز بالینی، صنایع غذایی، صنایع پتروشیمی، آزمایشگاههای پزشکی قانونی، تحقیقاتی، آزمایشگاههای آموزشی، صنایع دارویی و اهداف کنترل کیفیت کاربردهای مختلفی دارد. همچنین برای شناسایی و شناسایی گونههای مختلف آلی و معدنی، گروههای عاملی، مطالعات ایزومری و وجود کونژوگه و غیره استفاده میشود.
چرا از کووت کوارتز در طیف سنجی مرئی UV استفاده می شود؟
کووت های سیلیس ذوب شده و کوارتز بیشتر در طیف سنجی فرابنفش استفاده می شوند زیرا در ناحیه فرابنفش شفاف هستند، یعنی کوارتز نمی تواند نور ماوراء بنفش را جذب کند، بنابراین در اسپکتروفتومترهای فرابنفش استفاده می شود. مواد پلاستیکی و شیشه ای نور ماوراء بنفش را جذب می کنند که در نتیجه اختلال ایجاد می کند.
کدام آشکارسازها در طیف سنجی مرئی UV استفاده می شوند؟
متداول ترین آشکارساز مورد استفاده در طیف سنجی مرئی UV یک لوله فتو ضربی است. تکرار داینود با یک تفاوت پتانسیل جزئی در یک زاویه خاص ساختار یافته است. فوتون ورودی پس از اینکه هر بار چندین الکترون را از داینودها خارج می کند، به کاتد برخورد می کند.
کدام لامپ در طیف سنجی UV-vis استفاده می شود؟
لامپ های هیدروژن و دوتریوم (از 160 نانومتر تا 380 نانومتر) با لامپ هالوژن تنگستن (محدوده 240 نانومتر تا 2500 نانومتر) معمولاً برای طیف سنجی UV-vis استفاده می شوند.
محدوده طیف سنجی مرئی UV چقدر است؟
محدوده UV-vis از 180 نانومتر تا 780 نانومتر است. ناحیه فرابنفش شامل 180 نانومتر تا 400 نانومتر است در حالی که ناحیه مرئی از 400 نانومتر تا 780 نانومتر است.
طیف طیف سنجی UV-VIS را چگونه می خوانید؟
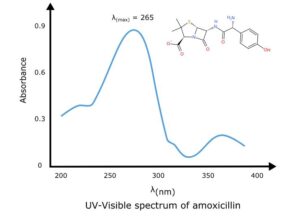
برای خواندن طیف UV-vis نمودار بین طول موج و جذب رسم می شود. طول موجی که حداکثر جذب در آن اتفاق می افتد λmax نامیده می شود.
حداکثر جذب چیست؟
طول موج مشخصه ای که در آن یک گونه شیمیایی حداکثر جذب را نشان می دهد، حداکثر جذب نامیده می شود. با λmax نشان داده می شود.
کروموفورها چیست؟
کروموفورها اتمها یا گروههایی از اتمها هستند که مسئول جذب تابش فرودی هستند (عمدتاً تشعشعات مرئی UV).
کاربرد طیف سنجی مرئی UV در محصولات طبیعی چیست؟
طیف سنجی UV-vis در تجزیه و تحلیل بسیاری از محصولات طبیعی استفاده می شود. برای شناسایی گونه های آلی و معدنی موجود در محلول استفاده می شود. همچنین برای اندازه گیری کمی اجزای مختلف در ترکیبات طبیعی، به عنوان مثال، برای یافتن غلظت ویتامین C در آب پرتقال و غیره استفاده می شود.
مزایا و معایب طیف سنجی مرئی UV چیست؟
طیف سنجی UV-Vis نتایج دقیقی را ارائه می دهد. این ابزار به راحتی قابل استفاده و دسته است. علاوه بر این، این یک تکنیک زمان بر است، آماده سازی آن دشوار است و نیاز به تلاش دارد زیرا نور خارجی و لرزش کوچک می تواند باعث تداخل در نتایج شود.
چرا متانول حلال خوبی برای طیف سنجی IR و UV است؟
متانول در هر دو ناحیه ماوراء بنفش و مرئی شفاف است. این یک نقطه برش در زیر این دو منطقه دارد بنابراین نمی تواند هیچ گونه تداخلی در نتایج ایجاد کند. بنابراین، حلال خوبی برای طیفسنجیهای UV و IR است.
چرا بیشتر باندهای جذب در طیف مرئی UV بسیار وسیع هستند؟
بسیاری از انتقالهای الکترونیکی توسط مولکولهای مختلف رخ میدهند که هر کدام کمی با یکدیگر متفاوت هستند. تشخیص یا تشخیص تعداد زیادی از خطوط با فاصله نزدیک برای دستگاه دشوار است، از این رو طیف وسیعی را ارائه می دهد.
کاربرد اسپکتروفتومتر UV-Vis چیست؟
اسپکتروفتومتر UV-Vis برای تعیین و اندازه گیری کمی آنالیت های مختلف مانند مولکول های آلی، معدنی، بیولوژیکی و غیره استفاده می شود.
چرا طیف UV گسترده تر از طیف IR است؟
در طیف فرابنفش، تغییرات در تمام سطوح انرژی (یعنی سطوح انرژی چرخشی، ارتعاشی و الکترونیکی) مشاهده می شود در حالی که در IR فقط سطوح انرژی ارتعاشی مشاهده می شود. بنابراین، طیف UV گسترده تر از طیف IR است.
تفاوت بین طیف جذب، انتشار و تحریک برای طیف سنجی مرئی UV چیست؟
تفاوت اصلی بین جذب، برانگیختگی و طیف انتشار، نوع تابش مورد مطالعه برای تجزیه و تحلیل ترکیبات شیمیایی مربوطه است. در طیف های جذبی، نور جذب شده با نور عبوری مطالعه می شود. آن نور عبوری نور جذب شده یا از دست رفته را به عنوان تفاوت در گذرگاه خالی و نمونه نشان می دهد. در حالی که در طیف انتشار، مانند طیف فلورسانس، شدت فلورسانس به عنوان تابعی از طول موج تحریک در نظر گرفته می شود.
انرژی که برای اولین بار توسط الکترون یک اتم جذب می شود، بازتاب می شود. همانطور که انرژی کوانتیزه میشود، الکترونهایی که برانگیخته میشوند، مقدار معینی انرژی به دست میآورند و با بازگشت به حالت اولیه، همان انرژی را آزاد میکنند.
چرا اتانول حلال خوبی برای اندازه گیری UV است اما برای IR نه؟
اتانول برای اندازه گیری اشعه ماوراء بنفش خوب است زیرا نقطه برش آن 210 نانومتر است که نزدیک به مرزهای پایین UV (190 نانومتر تا 400 نانومتر) است بنابراین با نتایج مناطق فرابنفش تداخلی ندارد. در حالی که اتانول دارای یک گشتاور دوقطبی است، به این معنی که IR فعال است، بنابراین با نتایج تداخل دارد.
تفاوت رنگ سنجی و اسپکتروفتومتری چیست؟
رنگ سنجی فقط برای ترکیبات رنگی استفاده می شود در حالی که اسپکتروفتومتری برای ترکیبات مختلف رنگی یا بی رنگ استفاده می شود. اسپکتروفتومتری شامل طیف گسترده ای از طول موج ها یعنی فرابنفش، مرئی و IR است.
چرا مقدار جذب UV منفی می شود؟
مقدار منفی جذب نشان می دهد که نمونه دارای ناخالصی است که باعث تداخل در نتیجه می شود. فلورسانس ناشی از ناخالصی می تواند ارزش تابش ارسالی را در مقایسه با تابش فرودی افزایش دهد. به همین دلیل است که مقدار جذب منفی می دهد.
چرا اشکال جامد نمونه برای طیف سنجی UV vis مناسب نیستند؟
برای طیف سنجی UV-vis، آنالیت باید به صورت محلول باشد زیرا برهمکنش تابش از این طریق موثر است. نور با تمام مولکول های آنالیت به صورت محلول برهم کنش می کند و مانند حالت جامد احتمال تلفات بسیار کم است.
تفاوت بین صفر و پایه در طیف سنجی UV Vis چیست؟
صفر در طیف سنجی UV میزان عبور کل را نشان می دهد در حالی که خط پایه مقدار تابش جذب شده توسط کووت و محلول نمونه است.
منابع
طیف سنجی UV/Visible: طیف سنجی جذبی توسط Ujjwal Sahoo
مقدمه ای بر طیف سنجی توسط Pavia، Lampman، Kriz، Vyvyan نسخه چهارم
شیمی تحلیلی مدرن اثر دیوید هاروی
تکنیک های ابزاری شیمی تجزیه توسط مهیندر سینگ.



















نظرات